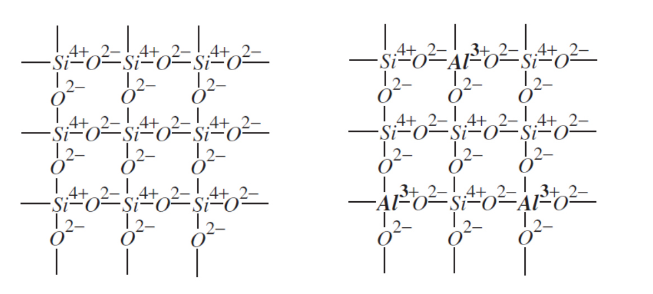Podemos representar un intercambiador iónico como A+X-, donde A+ es el ion soluble. Si se coloca AX en una solución que contiene sal BY, en la solución se ioniza para dar los iones B+ e Y-, la reacción de intercambio se puede escribir de la siguiente manera:
Esto representa una reacción de desplazamiento simple entre dos sales AX y BY. Dado que Y no participa en la reacción, la ecuación se puede simplificar a:
En este ejemplo, se intercambian cationes; sin embargo, los aniones se pueden intercambiar de la misma manera. Si recuerdas la química, cuando observas reacciones químicas, dos iones que tienen la misma carga no significa necesariamente que puedan intercambiar lugares; también depende de la actividad relativa del ion. Hay gráficos en química llamados “Serie de actividades” que puedes usar para predecir si un ion reemplazará a otro ion.
La forma más simple de reacciones de intercambio iónico es la fase líquida, que es lo que ocurre dentro de muchos sistemas de baterías. Si tomamos dos soluciones, una que contiene Zn(CN)2 y la otra que contiene Hg(NO3)2 y mezclamos estas dos soluciones, se produce una reacción de intercambio iónico:
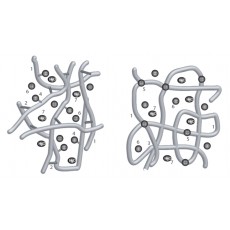
donde A y B son los iones y la doble barra indica la ubicación en la superficie. Debido a la característica hidrófila de los grupos cargados, estas moléculas poliméricas son solubles en agua. Por lo tanto, para evitar que estas moléculas se disuelvan en agua, el polímero debe reticularse para formar una estructura polimérica tridimensional. Los polímeros reticulados no son solubles en agua, pero pueden hincharse con un alto grado de contenido de agua. Esto permite que las moléculas de agua y los iones viajen a través de la red polimérica llena de agua y participen en las reacciones de intercambio iónico.
Figura 1. Polímero reticulado con grupos carboxílicos.c
Densidad de entrecruzamiento: la densidad de entrecruzamiento entre cadenas poliméricas se denomina densidad de entrecruzamiento. El número de enlaces cruzados puede hacer que la estructura del polímero sea rígida o similar a un gel; influye en la elasticidad, la capacidad de hinchamiento y la movilidad de los iones que viajan a través de la matriz. Los materiales que tienen altas densidades de reticulación son rígidos y, a menudo, más estables. Sin embargo, la difusión de iones puede ser lenta. Los materiales con bajas densidades de reticulación pueden ser más blandos y gelatinosos y permitir interacciones iónicas más rápidas. Por lo tanto, la selección del material apropiado dependerá de la estabilidad y las tasas de movilidad iónica requeridas.
Intercambiadores de aniones y cationes: Los materiales de intercambio iónico se clasifican en intercambiadores de cationes e intercambiadores de aniones. Los intercambiadores de cationes tienen grupos funcionales cargados negativamente y transportan cationes intercambiables. Los intercambiadores aniónicos transportan aniones debido a la carga positiva de sus grupos funcionales.
donde A es el contraión con valencia Z, y representa la relación SiO2/Al2O3 y W es el contenido de agua en la forma hidratada de la zeolita. El valor de y suele estar entre 2 y 10, pero puede llegar hasta 100 en zeolitas con “alto contenido de sílice”. En la Figura 3 se muestra una ilustración gráfica de una zeolita con fórmula general (MeO4) m. En (a), la estructura consta de unidades de SiO2 (sílice). Las cargas positivas de los iones Si4+ están equilibradas por las cargas negativas del O2-. En (b), hay un reemplazo parcial de Si4+ con iones Al3+. El reemplazo de iones da como resultado un exceso de carga negativa compensado por la presencia de contraiones que no están incluidos en las unidades de óxido. Los contraiones son iones intercambiables transportados por intercambiadores de iones que pueden moverse libremente dentro del marco, pero su movimiento se compensa con contramovimientos de otros iones de la misma carga para cumplir el principio de electroneutralidad. Los contraiones se mantienen en los poros cristalinos y no se muestran en 3(b) por simplicidad.
Figura 3. Ilustración pictórica de una zeolita con fórmula general (MeO4)m (a) Estructura no cargada de sílice y (b) estructura cargada de una zeolita.
Capacidad de intercambio iónico
La capacidad de intercambio iónico es una característica importante de los materiales de intercambio iónico. Se puede considerar un material de intercambio iónico como un material que contiene una cierta cantidad de sitios de carga fija disponibles para los contraiones. Esta afirmación se puede expresar como el número de equivalentes de contraión en una cantidad específica de material. Es difícil comparar las capacidades de intercambio iónico de diferentes materiales porque la disponibilidad de los grupos funcionales para las reacciones de intercambio nunca alcanzó el 100%. En el proceso participan diferentes fracciones de los grupos funcionales dependiendo de propiedades como el grado de hinchamiento, el tamaño del ión y el límite de contacto entre la fase del intercambiador de iones y el medio circundante. Por lo tanto, a veces se utiliza una capacidad condicional (capacidad exhibida bajo ciertas condiciones particulares) para describir y comparar intercambiadores de iones.
El método más preciso para estimar la capacidad de intercambio iónico es utilizar una capacidad teórica, que es el número de grupos funcionales por unidad de peso del intercambiador de iones seco. Esto se puede obtener analizando directamente el material. Por ejemplo, cada átomo de azufre corresponde a un grupo funcional en un polímero sulfonado; por tanto, el número de grupos funcionales puede derivarse del contenido de azufre. La capacidad teórica se puede expresar como:
Donde Ms es la masa de azufre, mr es la masa del polímero, W es la fracción de agua en la muestra y 32 es el peso atómico del azufre. También existen otras formas de estimar QTheor, como a partir de las condiciones de síntesis. La capacidad teórica no tiene uso práctico, pero permite comparar membranas en condiciones ideales (teóricas).
Resumen
Hay una serie de propiedades químicas y físicas que se pueden utilizar para describir y comparar materiales de intercambio iónico. Algunas de las propiedades químicas son (1) el tipo de matriz, (2) el grado de reticulación, (3) los tipos de grupos funcionales, (4) la capacidad de intercambio iónico y (5) la forma iónica. Las propiedades físicas relevantes incluyen (1) estructura física y morfología, (2) área de superficie, (3) tamaño de poro y (4) volumen o espesor en el estado hinchado. Sin embargo, las características reales del material dependen del tipo de grupos funcionales y matriz, el grado de reticulación, la capacidad de intercambio iónico, el área de contacto de la superficie, los iones disponibles, la cantidad de agua y la composición del medio circundante, entre otras variables.