
Captura y conversión de dióxido de carbono
Introducción a la captura y conversión de CO2
Los dispositivos electroquímicos que convierten el CO2 en combustibles y compuestos valiosos han sido objeto de extensas investigaciones durante más de una década. La investigación en esta área ha sido impulsada por el deseo de reducir la dependencia de los combustibles fósiles y reducir las emisiones de efecto invernadero. Como probablemente sepa, la mayor parte de la energía mundial utilizada para el transporte, la industria y los usos residenciales se obtiene del carbón, el petróleo y el gas natural.
Un aumento de las emisiones de CO2
Como todos sabemos, el consumo de combustibles fósiles ha provocado un aumento de las emisiones de CO2. Como resultado, la concentración global de CO2 atmosférico ha aumentado aproximadamente un 20% desde 1980 (ver Figura 1) [1]. La acumulación de CO2 aumenta la capacidad de la atmósfera para absorber y remitir la radiación infrarroja, lo que provoca el calentamiento planetario. Esto provoca cambios en los patrones climáticos (es decir, inundaciones, sequías, tormentas) y hace que los casquetes polares se derritan, lo que provoca un aumento del nivel del mar junto con una mayor acidez de los océanos debido al aumento de la ingesta de CO2. Por lo tanto, serían beneficiosas las tecnologías que puedan disminuir la concentración atmosférica de CO2. Hay varias formas de disminuir la huella de CO2 (1) utilizar energía renovable o no basada en carbono, (2) captura y almacenamiento de CO2 y (3) conversión de CO2. A largo plazo, necesitaremos incorporar estas tres acciones en nuestros planes nacionales y regionales de energía y cambio climático.

Figura 1. Emisiones de CO2 por tipo de combustible [1].
Otros productos derivados de combustibles fósiles
Si pudiéramos reducir significativamente nuestra dependencia de los combustibles fósiles para obtener energía, todavía tendríamos la cuestión de cómo producir todos los demás productos derivados de los combustibles fósiles. La mayoría de la gente no se da cuenta de que los combustibles fósiles también se utilizan en innumerables actividades no combustibles para generar productos químicos básicos. Una vez capturado el CO2, se utiliza como materia prima química para sintetizar muchos tipos de polímeros C1, C2, C3 y de cadena larga. En realidad, casi todos los objetos que utilizamos a diario tienen algo que ver con combustibles fósiles. Los combustibles fósiles se utilizan para crear plásticos, disolventes, recubrimientos, fertilizantes y muchos otros productos. La Figura 2 muestra un ejemplo de un proceso de gasificación de carbón utilizado para crear diversos productos químicos utilizados en productos domésticos comunes.
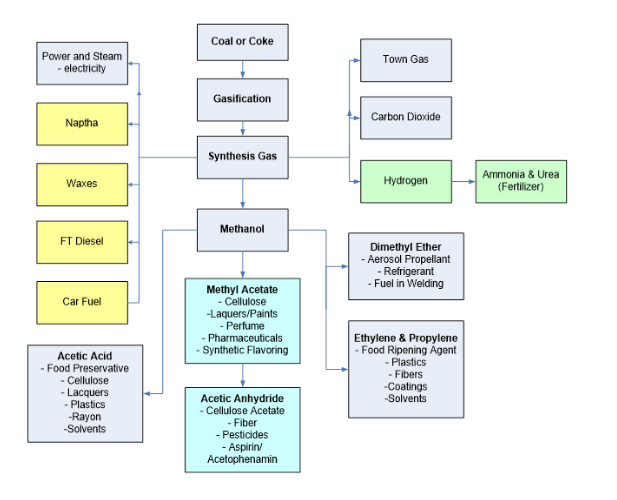
Figura 2. Proceso de gasificación química de Eastman [2].
¿Cómo podemos capturar CO2?
Muchas técnicas de captura de CO2 están siendo objeto de investigación y desarrollo. El CO2 puede capturarse de centrales eléctricas, fábricas de cemento, gases de escape de vehículos, agua de mar y directamente de la atmósfera. El método más económico de captura de carbono es el de una planta industrial estacionaria porque las corrientes de gases de combustión tienen altas concentraciones de CO2 (>95%) y el CO2 se puede obtener por tan solo $5 por tonelada [3]. El costo de la extracción de agua de mar y aire ambiente puede ser entre 20 y 50 veces mayor que el de extraer el CO2 de una corriente de gases de combustión, por lo que todavía es necesario realizar una cantidad significativa de I+D para extraer. el CO2 de estas fuentes [3].
¿Cómo se convierte el CO2 en otros productos?
Se han investigado varios enfoques para la conversión de CO2, incluidos el electroquímico, el solar, el químico y el biológico. Los procesos de investigación y desarrollo electroquímicos que se están investigando actualmente tienen el potencial de ayudar en la sustitución de los combustibles fósiles. Entre ellas, las reacciones electroquímicas son las más atractivas debido a su alta eficiencia energética y condiciones de reacción suaves. Sin embargo, estos procesos requieren una cantidad significativa de aporte de energía; por lo tanto, tendrían que integrarse con sistemas de energía renovable. Cuando se utiliza con un sistema de energía renovable como la eólica o la solar, el CO2 puede convertirse durante épocas de exceso de generación de electricidad y luego almacenarse como combustible químico. Este combustible químico almacenado podría luego extraerse mediante combustión o electroquímicamente a través de una pila de combustible. De esta manera también se podrían derivar una variedad de productos químicos a base de carbono.
Reacciones químicas
La reacción química general que ocurre en el dispositivo electroquímico es:

La reacción química general se puede dividir en dos medias reacciones químicas. La reacción de evolución de oxígeno (REA) es:

La reacción de reducción de dióxido de carbono (CO2RR) es:

La ecuación 3 está escrita para mostrar que son posibles muchos productos que contienen carbono. Los productos reales obtenidos dependen de varios factores, pero el tipo de catalizador utilizado es el factor determinante más importante.
Como puede ver en (3), se requiere energía en forma de energía eléctrica para convertir la energía almacenada en los enlaces químicos de los compuestos producidos. En la reacción de CO2RR, la electricidad puede provenir de cualquier fuente, como eólica, solar, nuclear o hidráulica. Tanto los REA como el CO2RR requieren catalizadores para superar sus grandes barreras cinéticas. Para ambas reacciones, se necesita un exceso de potencia más allá de lo termodinámicamente requerido. El descubrimiento de catalizadores más activos aumentará la eficiencia energética de la producción electroquímica de productos químicos y combustibles.
Termodinámica de la reducción de CO2
En termodinámica, la energía libre de Gibbs se puede utilizar para calcular el trabajo reversible máximo realizado por un sistema termodinámico. La energía libre de Gibbs representa el costo energético neto de un sistema creado a una temperatura constante con un volumen insignificante, menos la energía del medio ambiente debida a la transferencia de calor. Esta ecuación es válida a cualquier temperatura y presión constantes para la mayoría de los sistemas electroquímicos. De la segunda ley de la termodinámica, el trabajo útil máximo (cambio de energía libre) que se puede obtener cuando una celda electroquímica «perfecta» funciona de manera irreversible depende de la temperatura. Así, Welec, la potencia eléctrica producida es [4]:

donde G es la energía libre de Gibbs, H es el contenido de calor (entalpía de formación), T es la temperatura absoluta y S es la entropía. Tanto la entalpía como la entropía de la reacción también dependen de la temperatura. El potencial de un sistema para realizar trabajo eléctrico mediante una carga, Q (culombios) a través de una diferencia de potencial eléctrico, E en voltios es:

Si se supone que la carga la llevan a cabo electrones:

donde n es el número de moles de electrones transferidos y F es la constante de Faraday (96.485 culombios por mol de electrones).
Cuando un sistema se transforma del estado inicial al estado final, la disminución de la energía libre de Gibbs es igual al trabajo realizado por el sistema hacia sus alrededores. Por lo tanto, la espontaneidad de una reacción determinada se puede medir mediante el cambio de energía de Gibbs (ΔG), específicamente, el cambio negativo en la energía de Gibbs es un signo de espontaneidad. La energía de Gibbs es función de la temperatura y la presión, lo que dificulta controlar con precisión la espontaneidad. La combinación de las últimas tres ecuaciones nos permite calcular el voltaje reversible máximo proporcionado por la celda; por lo tanto, ΔG puede controlarse con precisión mediante el potencial aplicado, como se muestra en la ecuación 7 [4].

donde n es el número de electrones transferidos en la reacción electroquímica, F es la constante de Faraday y Ecell es el potencial de la celda. De esta forma, la electroquímica permite el control directo del ΔG de una reacción y, por tanto, de su espontaneidad. Calculados a partir de la energía de Gibbs, los potenciales estándar para la reducción de CO2 en productos electroquímicos comúnmente reportados se enumeran en la Tabla 1. El potencial termodinámico de la celda nos ayuda a estimar el requerimiento mínimo de energía para un producto determinado y, por lo tanto, dado el costo de la energía, proporciona una Método para estimar la viabilidad económica de un producto.
Tabla 1. Potenciales de equilibrio de ejemplos de medias reacciones de CO2RR [5].

La reducción del dióxido de carbono también se puede lograr utilizando un dispositivo fotoelectroquímico, donde los catalizadores para la reacción se acoplan directamente a la superficie del dispositivo semiconductor. Esto permite el acoplamiento de catalizadores para la reacción directamente a la superficie del semiconductor. Este enfoque requiere encontrar un semiconductor con las propiedades deseadas para generar la energía necesaria para reducir el CO2. Los dispositivos fotoelectroquímicos tienen requisitos similares a los dispositivos electroquímicos; por lo tanto, se pueden crear catalizadores para desarrollar aún más ambos tipos de sistemas.
¿Es rentable la reducción de CO2?
Como toda nueva tecnología, la viabilidad de la utilización del CO2 dependerá en gran medida del coste. El mayor coste de la reducción de CO2 será el precio de la electricidad. Por lo tanto, una de las formas de reducir los costos es encontrar un mejor catalizador para aumentar la eficiencia y reducir el costo. La escala también es un factor importante al investigar sistemas electroquímicos de CO2. Para satisfacer las demandas de productos químicos, el dispositivo electroquímico debe tener una alta tasa de producción. Afortunadamente, ya existen procesos electrolíticos para refinar aluminio y para el proceso cloro-álcali, por lo que los ejemplos de estos sistemas electroquímicos a gran escala demuestran que un proceso electrolítico es capaz de satisfacer demandas a gran escala.
¿Cuál es el mejor producto para fabricar utilizando la reducción de CO2?
Al iniciar la investigación sobre CO2RR, una pregunta común es cómo determinar qué producto fabricar. El mejor método para determinar esto es realizar una investigación de mercado para descubrir qué productos tienen más probabilidades de tener un margen de beneficio mayor que otros. La Tabla 2 muestra el costo de electricidad de producir una tonelada métrica de cada producto suponiendo un potencial de 300 mV para CO2RR y REA. Compara el costo de la electricidad con el precio de mercado, que es una estimación del límite superior de posible beneficio. Además, al realizar una investigación de mercado, puede encontrar productos que no se crean fácilmente a partir de productos a base de petróleo. Los ejemplos incluyen ácido fórmico, metanol, etilenglicol y 1-propanol. También hay ciertos productos, como el metano y el etileno, que se producen de manera fácil y económica a partir de combustibles fósiles, por lo que no tendría sentido realizar investigaciones sobre dispositivos electroquímicos y catalizadores que puedan crear ese tipo de sistemas. Sin embargo, los cambios en los precios de la electricidad o los combustibles fósiles o las regulaciones gubernamentales podrían cambiar fácilmente el precio de los productos derivados del CO2.
Tabla 2. Estimación de costo simple para una tonelada métrica de cada producto de CO2RR considerado.

Conclusión
La conversión electroquímica de CO2 en combustibles y productos químicos es un enfoque prometedor para reducir el uso de combustibles fósiles. Se necesita una cantidad significativa de investigación y desarrollo para la captura de carbono y los catalizadores, pero existe un enorme potencial para que las tecnologías reduzcan el CO2 o prevengan una mayor contaminación por CO2. Con una mejor captura de carbono y mejores catalizadores, el proceso podría resolver los problemas de almacenamiento de energía para fuentes de electricidad intermitentes como la eólica y la solar, así como una fuente de productos químicos a base de carbono.
Referencias
[1] Roser, M. y Ritchie, H. (sin fecha). Emisiones de Co2 por combustible. Obtenido el 10 de marzo de 2021 de https://ourworldindata.org/emissions-by-fuel
[2] Spiegel, CS (2006). Oportunidades para productos a base de carbón: carbón limpio y tecnologías de procesamiento de carbón, 1.ª ed. Norwalk, CT: Investigación BCC.
[3] Metz, B., Davidson, O., Coninck, H. D., Loos, M. y Meyer, L. (2005). Captura y almacenamiento de dióxido de carbono. Prensa de la Universidad de Cambridge.
[4] Spiegel, CS (2008). Modelado y simulación de pilas de combustible PEM utilizando MATLAB, 1ª ed. Nueva York: Elsevier Science.
[5] Mistry, H., Varela, A. S., Bonifacio, C. S., Zegkinoglou, I., Sinev, I., Choi, Y., . . . Cuenya, B. R. (2016). Catalizadores de cobre activados por plasma altamente selectivos para la reducción de dióxido de carbono a etileno. Comunicaciones de la naturaleza, 7 (1). doi:10.1038/ncomms12123

