Introducción a las membranas de intercambio iónico y la división de sales
Las membranas de intercambio iónico (IEM) tienen muchas aplicaciones más allá de las pilas de combustible: también se pueden utilizar para sintetizar todo tipo de compuestos que se utilizan en diversas industrias. Los IEM más populares consisten en resinas poliméricas con grupos funcionales cargados en función de su selectividad iónica; se denominan membranas de intercambio aniónico (AEM) e intercambio catiónico (CEM). Los AEM tienen grupos funcionales cargados positivamente y permiten el paso de aniones. Por el contrario, los CEM tienen grupos funcionales cargados negativamente y permiten el paso de cationes. Un tercer tipo de membrana es la membrana bipolar (BPM), que puede generar iones hidroxilo y protones, y es particularmente útil en la síntesis de ácidos y bases. Los BPM constan de una capa de intercambio catiónico y una capa de intercambio aniónico, con un fino intermedio entre las dos capas. La capa intermedia a veces consiste en un ácido débil o un catalizador para mejorar la reacción deseada. La capa BPM ideal es no permeable a los iones de sal porque las altas concentraciones de iones de sal a menudo resultan en la contaminación de la membrana.
IEMS se puede utilizar para electrólisis de membrana (ME), electroelectrodiálisis (EED), metátesis de electrodiálisis (ED-M), electrodiálisis de sustitución iónica (ISED) y electrodiálisis con membrana bipolar (BMED). ME permite la electrosíntesis de compuestos inorgánicos y orgánicos mediante una reacción redox (reducción u oxidación) donde se obtienen los productos. En EED, ED-M e ISED, las reacciones de reemplazo iónico de sales orgánicas e inorgánicas permiten la síntesis de ácidos, bases y líquidos iónicos. El papel principal de IEM en estos procesos es la selectividad de las membranas hacia cationes y aniones para permitir la síntesis de compuestos químicos con alta pureza. La principal limitación suele ser el transporte electroosmótico del disolvente, que limita la concentración del producto en los sitios localizados.
Existen numerosos productos químicos que se pueden crear utilizando IEM mediante división electroquímica de sales (es decir, MX, donde M es un catión como Li+, Na+, K+ o amonio y X es un anión como fosfato, borato, acetato o nitrato). . Para demostrar cómo funciona este proceso, en esta publicación de blog mostraremos cómo se divide el sulfato de sodio para formar ácido sulfúrico e hidróxido de sodio.
División del sulfato de sodio en ácido sulfúrico e hidróxido de sodio
El sulfato de sodio se puede dividir en ácido sulfúrico e hidróxido de sodio mediante una celda electroquímica similar a una batería. Se pasa una solución de sulfato de sodio a través de la parte central de la celda en la Figura 1. Bajo un campo eléctrico, el sulfato se transporta a través de la membrana permeable a los aniones hacia el anolito y los iones de sodio pasan a través de la membrana permeable a los cationes hacia el catolito. Las reacciones en el ánodo y el cátodo generan protones e hidróxidos, que hacen que el ácido sulfúrico y el hidróxido de sodio se acumulen en el anolito y el catolito.
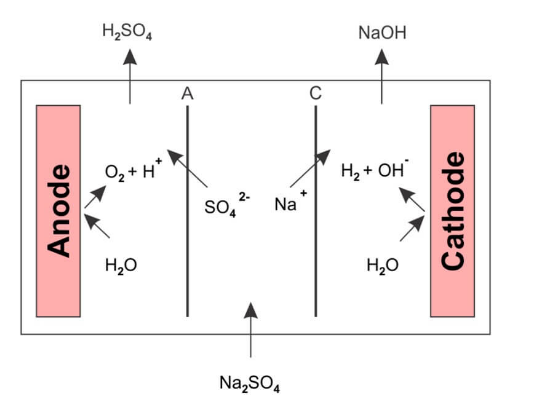
Figura 1. División de la sal del sulfato de sodio.
El diseño de este tipo de celda y el tipo de membrana seleccionado es crítico porque a medida que aumenta la concentración de ácido en la parte de anolito de la celda, la eficiencia actual cae debido a una migración hacia atrás de protones desde el compartimiento de anolito a través de la membrana de intercambio aniónico hacia la porción central de la célula. Esto, a su vez, hace que el pH en la corriente de electrolito central sea más ácido y reduce la eficiencia actual del hidróxido de sodio. La retromigración de protones a través de la membrana de intercambio aniónico es bien conocida y existen varios tipos de membranas que están diseñadas para minimizar la retromigración de protones.
Además del problema de la retromigración, un pH más bajo en la porción central de la célula también limita el tipo de membrana de intercambio catiónico que se puede utilizar. Las membranas de intercambio catiónico bicapa, como Nafion® 902, contienen polímeros perfluorados con grupos de intercambio de ácido sulfónico en un lado y grupos de intercambio de ácido carboxílico en el otro. La química de la membrana limita la migración hacia atrás de los iones de hidróxido, lo que permite alcanzar concentraciones básicas más altas con buena eficiencia. Existen otros tipos de membranas Nafion® que se pueden utilizar, dependiendo de la acidez de la porción central de la célula.
Membranas bipolares para la división de sal
Las membranas bipolares, como las que se utilizan para las pilas de combustible, también se pueden utilizar para dividir la sal (Figura 2). Estas membranas permiten la formación de hidróxido y protones sin la coproducción de hidrógeno y oxígeno. Una pila de división de sal puede tener unas pocas células o cientos de membranas celulares que contienen membranas bipolares, aniónicas y/o catiónicas entre un par de electrodos. Dependiendo del diseño, las pilas para dividir sal pueden producir diseños eficientes y rentables. Sin embargo, estos diseños también tienen problemas de estabilidad, como el transporte no deseado a través de la interfaz de la membrana.

Figura 2. División de la sal del sulfato de sodio mediante una membrana bipolar.
Conclusión
Muchos tipos de IEMS se pueden utilizar eficazmente en la síntesis química para la división de sales y generar iones de hidrógeno (H+) o hidroxilo (OH-) para la síntesis de ácidos o bases. Muchos tipos de membranas bipolares permiten la conversión de sales, tanto en soluciones acuosas como no acuosas, dividiéndose el disolvente (agua, alcohol) en un protón y un anión correspondiente. Esto permite que tanto las sales orgánicas como las inorgánicas se conviertan eficazmente en ácidos y bases. La principal limitación radica en la estabilidad de la membrana frente a ácidos concentrados o soluciones alcalinas. Nuestro ejemplo de división del sulfato de sodio en ácido sulfúrico e hidróxido de sodio es solo una sustancia química que se puede aplicar para la síntesis, reutilización o recuperación de ácidos o bases inorgánicos y orgánicos de las mezclas de reacción.

