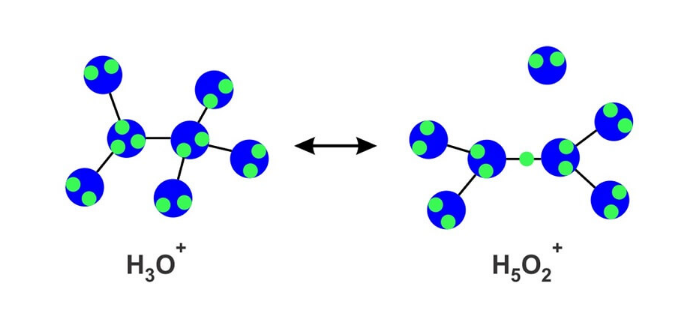
Aunque esta es la explicación actualmente aceptada para el transporte de hidróxido, no explica adecuadamente por qué se ha descubierto empíricamente que la movilidad del hidróxido es sólo el 57% de la movilidad del protón. Se han realizado numerosos experimentos para comprender los mecanismos de transporte de iones. El complejo OH- hipercoordinado se ha observado en experimentos de dispersión de neutrones y rayos X, mientras que los datos de espectroscopia FTIR respaldan la existencia de un enlace de hidrógeno débil entre el hidrógeno en OH- y el oxígeno en H2O. Sin embargo, otros estudios informan que, aunque el OH- hipercoordinado es prominente, su población no es tan dominante como se cree y existe una fracción sustancial de OH- tricoordinado. Se han propuesto otros mecanismos y los detalles exactos del transporte de hidróxido están en debate. Si bien los mecanismos de transporte detallados no se comprenden completamente, en general se acepta que la solvatación en agua es fundamental para la migración eficiente del anión hidróxido.
Comparación con PEM
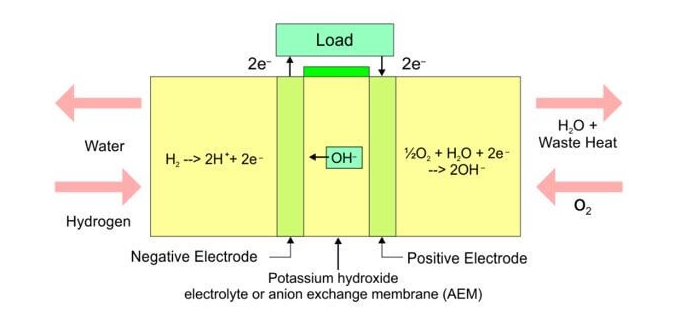
Hay tres limitaciones principales de los materiales AEM actuales: (1) conductividades de hidróxido, (2) mala estabilidad química y (3) degradación del electrolito a temperaturas elevadas. Dado que el transporte de hidróxido es aproximadamente un 50% más lento que el transporte de protones en el agua, se espera que la conductividad celular sea menor para membranas con el mismo espesor que las PEM. Muchos AEM también exhiben una estabilidad química deficiente en condiciones alcalinas, lo que resulta en una vida útil operativa insuficiente para los dispositivos electroquímicos que utilizan AEM. La eficiencia de las pilas de combustible y los electrolizadores aumenta a temperaturas elevadas, pero la degradación del electrolito es pronunciada a temperaturas más altas.
Baja conductividad iónica: como se analizó anteriormente, la menor conductividad de los AEM en comparación con los PEM se debe a que el anión hidróxido tiene una movilidad en solución diluida que es solo el 57 % de la del protón, lo que lleva a una limitación cinética fundamental. Por lo tanto, la densidad de carga de un AEM debe ser aproximadamente dos veces mayor que la de un material PEM comparable. Para aumentar el transporte de hidróxido, podemos aumentar el número de grupos cargados en la membrana (capacidad de intercambio iónico (IEC)) y aumentar y mantener el nivel de hidratación para crear canales de agua que faciliten el transporte de hidróxido. Sin embargo, existe un equilibrio delicado porque las densidades de carga más grandes dan como resultado una hinchazón excesiva, una dilución de la carga y una integridad mecánica disminuida. Se requiere una conductividad del hidróxido de > 100 mS/cm para lograr densidades de energía competitivas y algunas de las membranas han logrado alcanzar este objetivo.
Estabilidad: La estabilidad de los AEM es una preocupación principal para las celdas electroquímicas porque necesitan funcionar durante al menos 5000 horas para poder competir con las tecnologías energéticas heredadas. Muchos AEM exhiben una estabilidad química deficiente debido a la naturaleza alcalina del material: la fuerte naturaleza nucleofílica del anión hidróxido conduce a múltiples vías de degradación tanto para el catión colgante como para la cadena principal del polímero. Las condiciones alcalinas hacen que la cadena principal del polímero y los cationes se degraden con múltiples subproductos, como alcoholes y aminas terciarias. Además, dependiendo de la química, algunas de las membranas sufren reacciones de deshidratación que liberan una molécula de agua y una amina terciaria. Además, en muchos sistemas AEM, el ataque de hidróxido de restos catiónicos conduce a la neutralización de la carga y a una rápida pérdida de conductividad. Los investigadores han estado trabajando para hacer que los AEM sean más estables mediante varios métodos, como alterar las longitudes de las cadenas unidas al amonio cuaternario para formar un catión más estable o crear una molécula menos «voluminosa» para que el hidróxido pueda moverse más fácilmente. Actualmente se están desarrollando muchos otros métodos para mejorar la estabilidad.
Degradación a Altas Temperaturas: La degradación a altas temperaturas se debe a la degradación de los grupos de amonio cuaternario por los iones nucleofílicos OH- a través de (1) un desplazamiento nucleofílico directo y/o (2) una reacción de eliminación de Hofmann, formando una amina terciaria y metanol. La cantidad de degradación depende de la temperatura. La forma conductora de hidróxido de la membrana también puede convertirse en forma de carbonato si se expone a 400 ppm de CO2 en el aire. La conversión de la membrana a la forma carbonato o bicarbonato da como resultado una menor movilidad de los grupos OH-.
Conclusión
Idealmente, el AEM debería tener una alta conductividad de hidróxido, una alta estabilidad química, ninguna conductividad electrónica y una buena integridad mecánica con la absorción de agua adecuada. Para crear una membrana de intercambio iónico mejorada para una aplicación particular, es necesario considerar simultáneamente las propiedades de transporte y estabilidad. Los AEM tienen un gran potencial para aplicaciones futuras debido a su bajo costo y a sus múltiples restos químicos en desarrollo.