Cómo predecir el rendimiento de la pila de combustible
El rendimiento de una pila de pilas de combustible se puede estimar utilizando algunas ecuaciones combinadas con algunos datos de entrada. Una forma común de caracterizar el rendimiento de diferentes pilas de combustible es mediante curvas de polarización. Aunque no puedes identificar problemas específicos con estas curvas, te permitirán calcular el rendimiento general. En la Figura 1 se muestra un ejemplo de curva de polarización.

Figura 1. Ejemplo de una curva de polarización PEMFC.
There are three distinct regions of a fuel cell polarization curve:
• A bajas densidades de potencia, el potencial de la celda cae debido a la polarización de activación.
• A densidades de corriente moderadas, el potencial de la celda disminuye linealmente con la corriente debido a pérdidas óhmicas.
• A altas densidades de corriente, la caída de potencial de la celda se aparta de la relación lineal con la densidad de corriente debido a la polarización de la concentración (pérdidas por transporte de masa).
Ejemplo: Una pila de pilas de combustible de hidrógeno y aire con un área activa de 25 cm2 tiene 25 celdas y funciona a una temperatura de 60 °C. Tanto el hidrógeno como el aire se alimentan a la pila de combustible a una presión de 3 atm. Cree la curva de polirización para esta pila de pilas de combustible.
Paso 1: Calcule el voltaje de Nernst
El primer paso para crear la curva de polarización es calcular el voltaje de Nernst. La forma común de la ecuación de Nernst es:

donde R es la constante del gas ideal, T es la temperatura, ai es la actividad de la especie i, vi es el coeficiente estequiométrico de la especie i y Er es el voltaje reversible en estado estándar, que es función de la temperatura y la presión.ç
A temperatura y presión estándar, el potencial teórico de una pila de combustible de hidrógeno-aire se puede calcular de la siguiente manera:
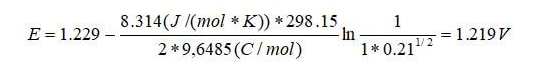
El potencial entre el cátodo de oxígeno donde se produce la reducción y el ánodo de hidrógeno en el que se produce la oxidación será de 1,229 V en condiciones estándar sin que fluya corriente. Cuando una carga conecta los dos electrodos, la corriente fluirá siempre que haya hidrógeno y oxígeno para reaccionar. La dependencia de la presión se anula porque tanto el ánodo como el cátodo están a 1 atm en nuestro ejemplo simple. Además, la actividad del agua se establece en función de la humedad relativa en el sitio de reacción, que es la unidad porque el agua se crea en la capa de catalizador catódico y no limita la reacción de ninguna manera.
Suponiendo que los gases son ideales (las actividades de los gases son iguales a sus presiones parciales y la actividad de la fase acuosa es igual a la unidad), la ecuación 1 se puede escribir como:

donde pi es la presión parcial de la especie i y p0 es la presión de referencia. Para nuestro ejemplo, el voltaje de Nernst se puede calcular usando la siguiente ecuación:

En primer lugar se calcularán las presiones parciales de agua, hidrógeno y oxígeno. Primero calcule la presión de saturación del agua:

Calcule la presión parcial del hidrógeno:

Las otras constantes necesarias para la ecuación de Nernst son la función de Gibbs en forma líquida, Gf liq= -228,170 J/mol, la constante de Faraday (Coulombs) = 96487, la constante del gas ideal (J/molK) = 8,314 y la temperatura en grados. K.
Paso 2: Calcule las pérdidas de activación
Las pérdidas de activación son el voltaje necesario para superar la energía de activación de la reacción electroquímica en la superficie catalítica. Este tipo de polarización domina las pérdidas a baja densidad de corriente y mide la eficacia del catalizador a una determinada temperatura. El catalizador reduce la altura de la barrera de activación, pero persiste una pérdida de voltaje debido a la lenta reacción del oxígeno. El sobrepotencial de polarización de activación total es de 0,1 a 0,2 V, lo que reduce el potencial máximo a menos de 1,0 V incluso en condiciones de circuito abierto. Las expresiones de sobrepotencial de activación se pueden derivar de la ecuación de Butler-Volmer. El sobrepotencial de activación aumenta con la densidad de corriente y se puede expresar como:

donde i es la densidad de corriente e i0 es la densidad de corriente de intercambio de reacción. La densidad de corriente de intercambio representa la velocidad de reacción. Las pérdidas por activación se pueden expresar como la ecuación de Tafel:

Para nuestro ejemplo, usaremos el coeficiente de transferencia, α, que es 0,5, la densidad de corriente de intercambio, i0, es 10-6,912 A/cm2, la constante de Faraday (Coulombs) F = 96487, la constante del gas ideal (J/molK) R = 8,314, y la temperatura en grados K.
Paso 3: Calcule las pérdidas óhmicas
Los materiales conductores tienen una resistencia intrínseca al flujo de carga, lo que resulta en una pérdida de voltaje de la celda llamada «polarización óhmica». Los componentes de la celda que contribuyen a la resistencia eléctrica son el electrolito, la capa de catalizador, la capa de difusión de gas, placas bipolares, contactos de interfaz y conexiones terminales. La reducción de voltaje está dominada por pérdidas óhmicas internas a través de la celda de combustible. Esta pérdida de voltaje se denomina “pérdida óhmica” e incluye las contribuciones electrónica (Relec) e iónica (Rionic) a la resistencia de la pila de combustible. Esto se puede escribir como:

Rionic domina la reacción en la ecuación 9 ya que el transporte iónico es más difícil que el transporte de carga electrónica. Rionic es la resistencia iónica del electrolito y Relec incluye la resistencia eléctrica de placas bipolares, interconexiones de celdas, contactos y otros componentes de la celda a través de los cuales fluyen los electrones. En nuestro ejemplo, usaremos una resistencia interna, R, de 0,19 Ωcm2.
Paso 4: Calcule las pérdidas de concentración
Una pila de combustible debe recibir continuamente combustible y oxidante para producir electricidad, y los productos deben eliminarse continuamente para lograr la máxima eficiencia de la pila de combustible. El estudio de la transferencia de masa de especies no cargadas es importante porque puede provocar pérdidas importantes en el rendimiento de las pilas de combustible. Las concentraciones de reactivo y producto dentro de la capa de catalizador determinan el rendimiento de la pila de combustible. La pérdida de concentración se puede minimizar optimizando el transporte de masa en los electrodos de la pila de combustible y las estructuras de flujo.
El transporte de masa en los electrodos/estructuras de combustible de la pila de combustible está dominado por la convección y las leyes de la dinámica de fluidos, ya que los canales de flujo son de macroescala (normalmente en milímetros o centímetros). El transporte de masa de los electrodos de la pila de combustible se produce a microescala y está dominado por la difusión. Una forma estándar de calcular la pérdida de concentración de la pila de combustible (o pérdida de masa por transporte) puede expresarse mediante la ecuación:

donde c es una constante y puede tener la forma aproximada:

El comportamiento real de la pila de combustible suele tener un valor mayor que el que predice la ecuación. Debido a esto, c a menudo se obtiene empíricamente. La pérdida de concentración aparece con una alta densidad de corriente y es grave. Una pérdida de concentración significativa limita el rendimiento de la pila de combustible. En nuestro ejemplo, usaremos el siguiente formulario:

donde la densidad de corriente límite, iL, es 1,4 A/cm2, la constante de amplificación (α1) es 0,085 y la constante para el transporte de masa, k, es 1,1. Para asegurar que no haya valores negativos calculados para Vconc, las pérdidas de transporte masivo solo se calcularán si , de lo contrario Vconc = 0.
, de lo contrario Vconc = 0.
Paso 5: armar el modelo
Una sola celda de combustible proporciona un voltaje que depende de las condiciones operativas, como la temperatura, la carga aplicada y los caudales de combustible/oxidante. El voltaje de la celda cae debido a varios mecanismos de pérdida irreversibles (pérdidas de activación, óhmicas y de concentración). La pérdida se define como el cambio en el potencial de la celda (Virrev) respecto del potencial teórico (Vrev):

Por lo tanto, el voltaje de operación de la celda se puede representar como la desviación del voltaje ideal causada por estas polarizaciones:

donde Vact, Vohmic, Vconc representan activación, polarización óhmica (resistiva) y concentración de masa. Como se ve en la ecuación 2, la activación y la polarización de concentración ocurren tanto en el ánodo como en el cátodo, mientras que la polarización resistiva representa pérdidas óhmicas en toda la celda de combustible. La relación entre el potencial de la pila de combustible y la densidad de corriente (curva de polarización de la pila de combustible) se puede expresar como:

Al introducir los números en cada una de las ecuaciones, obtenemos la siguiente gráfica como resultado de nuestro ejemplo:
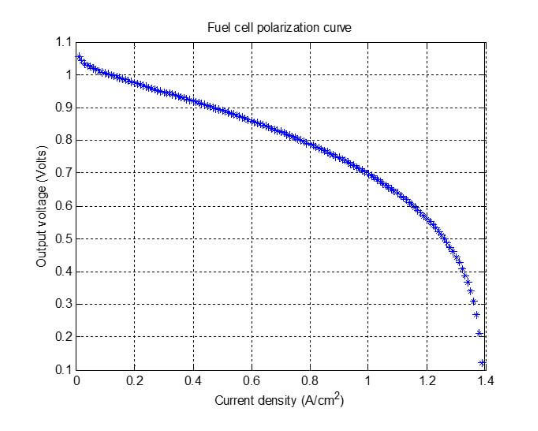
Figura 2. Curva de polarización generada para nuestro ejemplo.
La Figura 2 muestra la curva de polarización generada a partir de las ecuaciones utilizadas en el ejemplo de la publicación. Esta curva de polarización no coincidirá exactamente con la curva de polarización real de esta pila de pilas de combustible, pero es un buen comienzo. Es posible que sea necesario mejorar el modelo con formas más precisas de explicar los fenómenos que ocurren en la pila de combustible.
Conclusión
Esta publicación mostró cómo se puede construir un modelo de celda de combustible utilizando conceptos de electroquímica. La barrera de activación del catalizador debe superarse para convertir los productos en reactivos. Para bajar esta barrera de activación, se pierde una parte del voltaje llamada sobretensión de activación. El voltaje real de la pila de combustible también se ve afectado por la carga de la pila de combustible y las limitaciones del transporte masivo. Los cambios en el transporte de masa y carga se pueden notar observando cambios en la curva de polarización.

