Modelado de las capas catalizadoras
La capa de electrodo de la pila de combustible está formada por el catalizador y una capa porosa de difusión de gas. Cuando el combustible en los canales de flujo se encuentra con la capa del electrodo, se difunde hacia el electrodo poroso. El reactivo viaja a la capa del catalizador donde se divide en protones y electrones. Los electrones se mueven al circuito externo para alimentar la carga, y los protones viajan a través del electrolito hasta llegar al otro electrodo para formar agua. Independientemente del tipo de pila de combustible, la capa de catalizador debe ser muy eficaz para descomponer las moléculas en protones y electrones, tener una superficie elevada y ser preferentemente de bajo coste. Ha sido un desafío encontrar un catalizador económico que sea eficaz para descomponer el hidrógeno en protones y electrones.
Las pilas de combustible de electrolitos poliméricos tienen dos capas de catalizador donde se producen reacciones electroquímicas. En el ánodo, el hidrógeno se descompone en protones y electrones. Los electrones viajan a la tela de carbono, a la placa del campo de flujo, al contacto y luego a la carga. Los protones pasan a través de la membrana de intercambio de polímeros hasta el cátodo. En la capa del catalizador catódico, el oxígeno proviene del aire y se combina con los protones para formar agua. Las capas de catalizador suelen ser las más delgadas de la pila de combustible (de 5 a 30 micrones), pero suelen ser las más complejas debido a las múltiples fases, la porosidad y las reacciones electroquímicas.

Figura 1. Fenómenos de transporte de catalizadores.
La Figura 1 muestra un esquema de las capas del catalizador de la pila de combustible donde se producen las reacciones químicas en la interfase de dos fases entre el electrocatalizador y el electrolito. La microscopía electrónica de barrido (SEM) muestra una estructura de tipo aglomerado donde el electrocatalizador está soportado sobre un aglomerado de carbono y cubierto por una fina capa de membrana. Se han adoptado muchos enfoques para modelar la capa de catalizador, tanto modelos microscópicos como macroscópicos. La Tabla 1 muestra métodos y ecuaciones comunes para modelar la capa de catalizador.

Tabla 1. Ecuaciones utilizadas para modelar la capa catalizadora.
Descripción física de las capas del catalizador PEMFC
El electrodo de la pila de combustible es una fina capa de catalizador donde tienen lugar las reacciones electroquímicas. Los electrodos suelen estar hechos de una mezcla porosa de platino e ionómero soportados en carbono. Las partículas de catalizador deben tener contacto con conductores protónicos y electrónicos para catalizar reacciones. Además, debe haber pasajes para que los reactivos lleguen a los sitios del catalizador y para que salgan los productos de la reacción. El punto de contacto de los reactivos, el catalizador y el electrolito se denomina convencionalmente interfaz trifásica. Para lograr velocidades de reacción aceptables, el área efectiva de los sitios del catalizador activo debe ser varias veces mayor que el área geométrica del electrodo. Por lo tanto, los electrodos se hacen porosos para formar una red tridimensional, en la que se ubican las interfaces trifásicas (Figura 1).
El área superficial del catalizador es una característica muy importante de la capa de catalizador; por lo tanto, es importante tener partículas de platino pequeñas (4 nm o menos) con una gran superficie finamente dispersadas en la superficie del soporte del catalizador, que normalmente son polvos de carbono con un área mesoporosa alta (>75 m2/g). El material de soporte típico es Vulcan XC72R, Black Pearls BP 2000, Ketjen Black International o Chevron Shawinigan.
Tipos de modelos
Los modelos de capa catalizadora varían de cero a tres dimensiones en la literatura. Los modelos de dimensión cero no consideran la estructura real de la capa de catalizador. Los modelos unidimensionales representan los cambios generales a lo largo de la capa. También existen modelos bidimensionales y tridimensionales que constan de la capa de catalizador y el aglomerado. Los modelos de aglomerado pueden ser modelos macro o micro, dependiendo de cómo se calculen.
La capa de catalizador contiene muchas fases: líquida, gaseosa, diferentes sólidos y la membrana. Aunque varios modelos tienen diferentes ecuaciones, la mayoría de ellas se derivan de las mismas ecuaciones rectoras, independientemente de los efectos que se modelen. Una expresión tipo Butler-Volmer puede describir la reacción del ánodo en la mayoría de los casos excepto en aquellos que utilizan un combustible distinto del hidrógeno puro. En estos casos, el catalizador de platino se “envenena”. El monóxido de carbono se adsorbe en los sitios electrocatalíticos y disminuye la velocidad de reacción. Algunos modelos explican esto utilizando un equilibrio de sitio de monóxido de carbono y examinando los pasos de reacción involucrados. Para el cátodo, se utiliza comúnmente una expresión de tipo Tafel debido a la lenta cinética de la reacción de transferencia de cuatro electrones.
Hay muchos más modelos de cátodos que de ánodos en la literatura. Esto se debe a la velocidad de reacción más lenta del cátodo debido a los efectos de producción de agua y transferencia de masa. El ánodo casi siempre se puede modelar como un modelo de cátodo simplificado, excepto en el caso en que el hidrógeno no es puro y se incluye el envenenamiento del electrocatalizador. Los tipos comunes de modelos para la capa de catalizador se presentan en la Tabla 2 e incluyen modelos de interfaz, microscópicos, de electrodos porosos y de aglomerados.
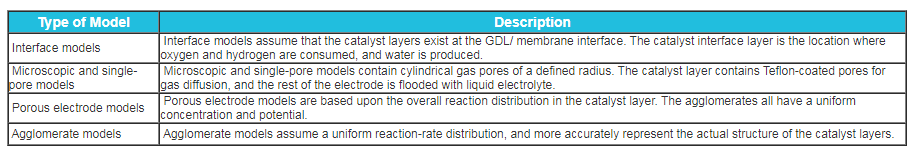
Tabla 2. Tipos de Modelos.
Modelos de interfaz
Muchos modelos de interfaz asumen que la capa de catalizador solo existe en la interfaz GDL/membrana. Esta suposición significa que las capas del catalizador son infinitamente delgadas y la estructura puede ignorarse. Hay varias formas de lograr esto en un modelo. Un método consiste en tratar la capa de catalizador como un lugar donde se consumen hidrógeno y oxígeno y se produce agua. Los modelos que se centran exclusivamente en la gestión del agua utilizan esta metodología con la ley de Faraday para el equilibrio de masa entre la membrana y el medio de difusión. La ley de Faraday es la velocidad a la que se consume hidrógeno y oxígeno y se genera agua, como se muestra en las ecuaciones 1 a 3:

donde N es la tasa de consumo (mol/s), I es la corriente (A) y F es la constante de Faraday (C/mol).
Un método más sofisticado para modelar la capa de catalizador es usar las ecuaciones 1 a 3 y luego usar una ecuación de curva de polarización para producir un potencial para la celda a una densidad de corriente específica:

La ecuación de Nernst se utiliza para determinar el potencial eléctrico teórico de la reacción. La ecuación 5 muestra el potencial de que el hidrógeno reaccione electroquímicamente con el oxígeno.

La ecuación de Nernst se utiliza para encontrar el potencial en las ubicaciones activas y el potencial local utilizando las semireacciones. Las ecuaciones para pérdidas de voltaje se pueden incorporar a la ecuación de Nernst para obtener una buena aproximación del potencial real de la pila de combustible.
Otro enfoque comúnmente utilizado para modelar las capas de catalizador es utilizar la ecuación de Butler-Volmer. La relación entre la densidad de corriente y las pérdidas de activación del ánodo es:

donde ia es la densidad de corriente de transferencia (A/m3), Vact son las pérdidas del electrodo de activación, io es la densidad de corriente de intercambio y αa es el coeficiente de transferencia de carga anódica. Para el cátodo:
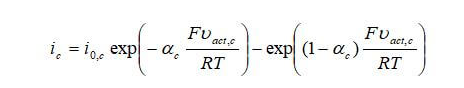
La densidad de la corriente de intercambio depende de la presión parcial local de los reactivos y de la temperatura local. A medida que disminuye la presión parcial de los reactivos, la densidad de la corriente de intercambio también disminuirá, lo que disminuye el rendimiento. Esto ilustra cómo las limitaciones de activación y difusión se afectan entre sí y por qué el flujo de masa debe resolverse con precisión. La densidad de corriente de intercambio para el ánodo y el cátodo es:

dónde y
y son la densidad de corriente de intercambio de referencia, γ1 + γ2 es el orden de reacción, T0 es la temperatura de referencia (303 K) y EA es la energía de activación.
son la densidad de corriente de intercambio de referencia, γ1 + γ2 es el orden de reacción, T0 es la temperatura de referencia (303 K) y EA es la energía de activación.
Modelos microscópicos y de poro único
Los primeros modelos de capas de catalizadores de pilas de combustible son modelos microscópicos de un solo poro. La capa de catalizador normalmente comprende poros recubiertos de teflón para la difusión de gas, mientras que el resto del electrodo se inunda con electrolito líquido. Estos modelos proporcionan un poco más de detalle sobre la microestructura de las capas de catalizador que los modelos de interfaz. Hay dos tipos principales de modelos de poro único: modelos de poro de gas y modelos de aglomerado inundado. En el modelo de poros de gas, se supone que los poros son poros de gas cilíndricos, rectos, de un cierto radio. Extienden la longitud de la capa de catalizador y las reacciones ocurren en la superficie. El segundo tipo de modelo también utiliza poros de gas, pero los poros están llenos de electrolito y catalizador. En estos poros se producen reacción, difusión y migración. Las ecuaciones que se introdujeron anteriormente (Ecuaciones 1 a 9) se utilizan principalmente en estos modelos.
En los modelos de aglomerado inundado, se utiliza la difusión junto con el uso del equilibrio para la concentración del gas disuelto en el electrolito. El modelo de aglomerado inundado muestra una mejor concordancia con los datos experimentales que el modelo de poro único, lo cual es de esperar porque modela mejor la microestructura real. Una desventaja de los modelos de poro único es que no tienen en cuenta la estructura real de la capa de catalizador, que tiene múltiples poros tortuosos. Sin embargo, los modelos de poro único han ayudado a formar algunos de los modelos posteriores, más complicados, que proporcionan resultados de simulación más realistas.
Modelos de electrodos porosos
Los modelos de electrodos porosos calculan la distribución general de la reacción en la capa de catalizador sin incluir los detalles geométricos exactos. Los modelos de electrodos porosos consideran la estructura de aglomerado, pero la capa tiene una concentración y potencial uniforme. Esta teoría se ocupa de la distribución general de la reacción en la capa de catalizador. Por lo tanto, los efectos principales no ocurren en los aglomerados y los aglomerados tienen una concentración y un potencial uniformes. El efecto de la concentración se tiene en cuenta en el cálculo de la resistencia a la transferencia de carga, que proviene de las expresiones cinéticas y probablemente no sea lineal. Las resistencias de transferencia de carga deben estar en paralelo con un condensador, lo que representa una carga de doble capa. Esto puede despreciarse para el funcionamiento en estado estacionario de las pilas de combustible e introducirse si se estudian transitorios o impedancia. Las ecuaciones rectoras para electrodos porosos se muestran en la Tabla 3.
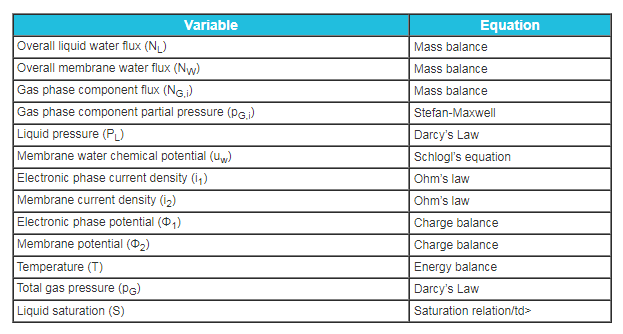
Tabla 3. Variables de la capa del catalizador de pilas de combustible.
El siguiente nivel de modelos trata las capas de catalizador utilizando un enfoque de modelado de electrodos porosos simple y completo. Por lo tanto, las capas de catalizador tienen un espesor finito y todas las variables se determinan como en la Tabla 3. Algunos de estos modelos suponen que la concentración del reactivo en fase gaseosa es uniforme en las capas de catalizador; la mayoría permite que la difusión se produzca en la fase gaseosa.
Modelos de aglomerado
Los modelos de aglomerado sólo consideran los efectos que ocurren en la escala de aglomerado. Suponen una distribución uniforme de la velocidad de reacción. Estos modelos representan con mayor precisión la estructura de las capas de catalizador que los modelos de electrodos porosos simples. Son similares a los modelos microscópicos, excepto que se promedia la disposición geométrica y cada fase existe en cada volumen de control. Se supone que la escala de longitud característica del aglomerado es del mismo tamaño y forma. En el modelo, el reactivo o producto se difunde a través de la película de electrolito que rodea la partícula y se aglomera donde se difunde y reacciona. Nuevamente, las ecuaciones son similares a las enumeradas en la Tabla 3, excepto que se utilizan coordenadas esféricas o cilíndricas para los gradientes.
Conclusión
Modelar la capa de catalizador es muy complejo porque tiene propiedades de todas las demás capas de la pila de combustible combinadas. Algunos de los fenómenos importantes que deben incluirse en un modelo riguroso de capa de catalizador incluyen equilibrios de masa, energía y carga junto con una relación que explica el contacto entre el GDL poroso y la capa de membrana polimérica. Además, saber cómo se distribuyen los aglomerados de catalizador a lo largo del GDL es un desafío. Las ecuaciones cinéticas son las más importantes a la hora de modelar la capa de catalizador. Las ecuaciones de uso común son la ley de Fick, las ecuaciones de Tafel y la ecuación de Butler-Volmer. Hay muchas opciones sobre cómo se modela la capa de catalizador, pero la complejidad del modelo debe estar determinada por el nivel de precisión requerido y los recursos disponibles para ayudar a crear el modelo.

