Hidruros químicos
Las pilas de combustible suelen utilizar hidrógeno comprimido como combustible; sin embargo, se pueden utilizar muchas otras fuentes de hidrógeno con pilas de combustible. El almacenamiento de hidruro químico es un método alternativo para producir hidrógeno mediante una reacción química. Estas reacciones involucran hidruros químicos, agua y alcoholes. Las reacciones químicas no son reversibles y los subproductos deben descartarse. El combustible de hidrógeno también se puede producir mediante una reacción química con “hidruros químicos” sólidos. Esta técnica se sitúa a medio camino entre los hidruros metálicos y el reformado. Productos químicos como el hidruro de litio, el hidruro de litio y aluminio y el borohidruro de sodio se pueden combinar con agua para desprender gas hidrógeno de forma exotérmica:


Estos compuestos son más ligeros que los hidruros metálicos reversibles y liberan más hidrógeno porque el hidrógeno se libera del reactivo agua. En la Tabla 1 se muestran tres ejemplos de hidruros químicos y sus capacidades de almacenamiento de hidrógeno.
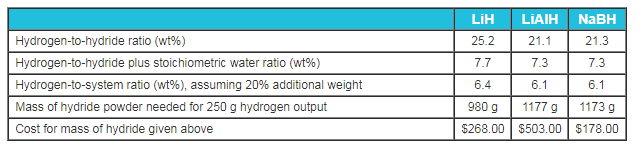
Tabla 1. Comparación química de hidruros.
Un aspecto esencial de un sistema de hidruro químico es el peso. El peso del sistema se puede estimar utilizando el hidruro químico, los cilindros de agua, el dispositivo mezclador y las válvulas de control. Por ejemplo, para que el LiH produzca 250 gramos de hidrógeno, se necesitarían 0,98 kg de hidruro motorizado, un tanque de agua de 2,2 kg y 200 g adicionales de sistemas de control y mezcla. Los hidruros químicos pueden estar contenidos de forma segura en pequeñas subunidades. Los hidruros deben almacenarse bajo nitrógeno o argón y protegerse del agua.
La generación de calor y el costo son los principales problemas asociados con los hidruros químicos. La menos exotérmica de las dos reacciones (LiAlH4) anterior produce 182 kJ de calor por mol de H2 liberado. Dependiendo del diseño del sistema y de la potencia, esto significa que se podrían generar varios kilovatios de calor. ¡Esto debe tenerse en cuenta al observar el diseño general del sistema! El costo de los hidruros metálicos es alto porque actualmente se fabrican en pequeñas cantidades y requieren más del 95 por ciento de pureza para fines experimentales. La solución de desecho sobrante que resulta de la reacción química se puede reprocesar para reducir los costos asociados con la fabricación de un nuevo lote de polvo de hidruro químico.
Reacciones de hidrólisis
Las reacciones de hidrólisis son hidruros químicos que reaccionan con el agua para producir hidrógeno. Una de las reacciones más comúnmente estudiadas es la del borohidruro de sodio y agua:
Un método común para activar la reacción es tener un líquido estabilizador inerte que proteja el hidruro del contacto con la humedad y también haga que el hidruro sea bombeable. Cuando se necesita combustible, la suspensión se mezcla con agua y la reacción resultante produce hidrógeno de alta pureza. Estas reacciones se pueden controlar cuidadosamente en un medio acuoso utilizando un catalizador y mediante pH. Aunque la capacidad de hidrógeno del material es alta y la cinética de liberación es rápida, esta reacción requiere que el agua y el combustible se transporten a bordo por separado, y que el borohidruro de sodio se regenere fuera del barco. Se están investigando muchos aspectos de este método de generación de hidrógeno, como el costo, el impacto del ciclo de vida y los requisitos de energía de regeneración. La Figura 1 muestra un ejemplo de un sistema de hidruro químico.

Figura 1. Un ejemplo de sistema de hidruro químico.
Otra reacción de hidrólisis que se está investigando es la reacción del MgH2 con agua para formar Mg(OH)2 y H2. Las partículas de MgH2 están contenidas en una suspensión no acuosa para inhibir la reacción cuando no se requiere hidrógeno. Las capacidades materiales de Mg(OH)2 pueden llegar al 11% en peso, pero este sistema de hidruro químico también enfrenta desafíos similares a los del sistema de borohidruro de sodio.
Reacciones de hidrogenación/deshidrogenación
Las reacciones de hidrogenación y deshidrogenación se han estudiado durante muchos años y varios sistemas tienen un potencial excelente para el almacenamiento de hidrógeno. Una de estas reacciones es la reacción de decalina a naftaleno, que puede liberar 7,3% en peso de hidrógeno a 210 ºC mediante la reacción:

La cinética del desprendimiento de hidrógeno se ve reforzada por un catalizador soportado a base de platino o de metal noble. Actualmente, las investigaciones se centran en reducir las temperaturas de deshidrogenación. Una ventaja de los sistemas de deshidrogenación es que no requieren agua. Las reacciones son endotérmicas, lo que significa que no hay calor residual que eliminar mientras se produce hidrógeno a bordo.
Otros enfoques químicos
Otros enfoques químicos que se están investigando incluyen la reacción de hidruros metálicos livianos como LiH, NaH y MgH2 con metanol y etanol (alcoholisis). La producción de hidrógeno a partir de estas reacciones se puede producir a temperatura ambiente. Al igual que las reacciones de hidrólisis, los productos de la reacción de alcohólisis deben reciclarse fuera del vehículo. Se debe llevar alcohol a bordo del vehículo, lo que afecta el peso, el volumen y la complejidad a nivel del sistema.
Otro nuevo enfoque químico es la generación de hidrógeno a partir de materiales de amoníaco-borano mediante la siguiente reacción:
Esta reacción ocurre a menos de 120 ºC y libera 6,1% en peso de hidrógeno. La cinética de liberación de hidrógeno y la selectividad se mejoran mediante la incorporación de partículas nanométricas de borano y amoníaco en una estructura mesoporosa. La Tabla 2 muestra una comparación de algunos tipos de materiales de almacenamiento de hidruros químicos.

Tabla 2. Materiales de almacenamiento de hidruros químicos.
Conclusión
Hay muchas opciones de combustible para diferentes tipos y sistemas de pilas de combustible. El tipo de combustible más limpio es el hidrógeno puro y existen múltiples métodos para generar hidrógeno puro in situ. Los métodos alternativos para producir hidrógeno son los hidruros químicos, las reacciones de hidrólisis, las reacciones de hidrogeneración/deshidrogenación y las reacciones de alcohólisis. Estos métodos de generación de hidrógeno pueden resultar ventajosos para crear hidrógeno para pilas de combustible y otras futuras tecnologías de energía alternativa.

