Transporte de electrones a través de la pila de combustible.
Si observa cualquier diagrama básico de celda de combustible, puede ver que la celda de combustible genera electrones. En los círculos científicos o de ingeniería, estos electrones tienen muchos nombres, pero un término común es «transporte de carga». El transporte de carga es el movimiento de cargas desde el electrodo (donde se producen) hasta la carga (donde se consumen). Hay dos tipos principales de partículas cargadas en las pilas de combustible: electrones e iones. El transporte iónico es mucho más difícil de predecir y modelar que el transporte de electrones. La transferencia de iones ocurre cuando los iones H+ viajan a través del electrolito. La resistencia al transporte de carga provoca una pérdida de voltaje en las pilas de combustible; esto se conoce como pérdida óhmica. Las pérdidas óhmicas se pueden minimizar haciendo que los electrolitos sean lo más delgados posible y empleando materiales de alta conductividad que estén bien conectados entre sí.
Los conductores tienen una resistencia intrínseca al flujo de carga, lo que resulta en una pérdida de voltaje de la celda. Este fenómeno se llama «polarización óhmica» y ocurre debido a la resistencia eléctrica en los componentes de la celda. Los componentes de la celda que contribuyen a la resistencia eléctrica son el electrolito, la capa de catalizador, la capa de difusión de gas, placas bipolares, contactos de interfaz y conexiones terminales. La reducción de voltaje está dominada por pérdidas óhmicas internas a través de la celda de combustible. Esta pérdida de voltaje se denomina “pérdida óhmica” e incluye las contribuciones electrónica (Relec) e iónica (Rionic) a la resistencia de la pila de combustible.

Esto se puede escribir como:

Rionic domina la reacción en la ecuación uno (1) ya que el transporte iónico es más difícil que el transporte de carga electrónica. Rionic es la resistencia iónica del electrolito y Relec incluye la resistencia eléctrica de placas bipolares, interconexiones de celdas, contactos y otros componentes de la celda a través de los cuales fluyen los electrones.
Conductividad (eléctrica)
La conductividad de un material es la capacidad del material para soportar el flujo de carga a través del material. La resistencia eléctrica de los componentes de la pila de combustible se expresa a menudo en la literatura como conductancia (σ), que es el recíproco de la resistencia:
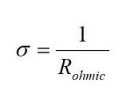
donde la resistencia total de la celda (Rohmic) es la suma de la resistencia electrónica, iónica y de contacto. La resistencia es característica del tamaño, forma y propiedades del material, como lo expresa la ecuación 3:
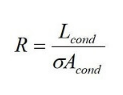
donde Lcond es la longitud (cm) del conductor, Acond es el área de la sección transversal (cm2) del conductor y σ es la conductividad eléctrica (ohm-1cm-1). La densidad de corriente, j , (A/cm2) se puede definir como:

donde Acell es el área activa de la pila de combustible, ncarriers es el número de portadores de carga (portadores/cm3), q es la carga en cada portador (1,6 x 10-19 C), Vdrift es la velocidad de deriva promedio (cm/s ) donde se mueven los portadores de carga y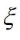 es el campo eléctrico.
es el campo eléctrico.
Si se reduce la resistencia de la pila de combustible, su rendimiento mejorará porque los electrones pueden viajar más fácilmente a través del material. La resistencia de la pila de combustible cambia con el área. Al estudiar las pérdidas óhmicas, es útil comparar las resistencias por unidad utilizando la densidad de corriente. Las pérdidas óhmicas se pueden calcular a partir de la densidad de corriente usando
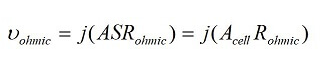
donde ASRohmic es la resistencia específica del área de la pila de combustible. Este parámetro permite comparar pilas de combustible de diferentes tamaños. Existen diferencias en los mecanismos de conducción para la conducción electrónica versus iónica. En un conductor metálico, los electrones de valencia asociados con los átomos del metal se desprenden y quedan libres para moverse alrededor del metal. En un conductor iónico típico, los iones se mueven hacia los intersticiales o vacantes en la red cristalográfica. Los iones se mueven de un sitio a otro, saltando a través de defectos en el material. El número de portadores de carga en un conductor electrónico es mucho mayor que en un conductor iónico. El transporte iónico y de electrones se muestra en las Figuras 1 y 2.
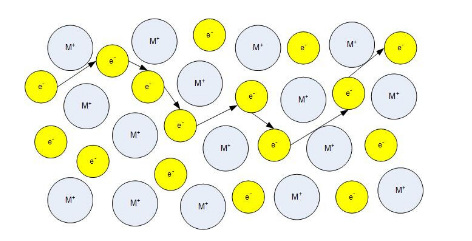
Figura 1: Transporte de electrones en un metal.
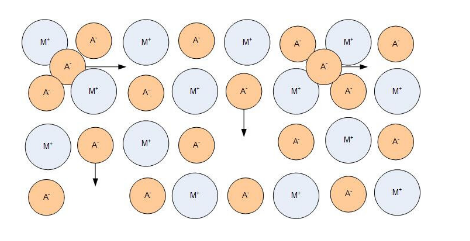
Figura 2: Transporte iónico en un conductor iónico cristalino
La Tabla 1 muestra un resumen y una comparación de los conductores electrónicos e iónicos y los componentes de la pila de combustible que se clasifican en cada tipo.

Tabla 1. Comparación de la conducción electrónica e iónica para componentes de pilas de combustible
Uno de los métodos más eficaces para reducir las pérdidas óhmicas es utilizar un mejor conductor iónico para la capa de electrolito, o una capa de electrolito más delgada, ya que el componente electrolítico de una pila de combustible domina las pérdidas óhmicas. En el caso de las pilas de combustible PEM, las membranas más delgadas son ventajosas porque mantienen saturado el electrodo del ánodo mediante la difusión «inversa» de agua desde el cátodo. A densidades de corriente muy altas (flujos de fluido rápidos), el transporte de masa provoca una caída rápida del voltaje, porque el oxígeno y el hidrógeno simplemente no pueden difundirse a través del electrodo ni ionizarse con la suficiente rapidez, y es posible que no puedan salir a la velocidad necesaria. velocidad.
Dado que el sobrepotencial óhmico de la pila de combustible se debe principalmente a la resistencia iónica en el electrolito, esto se puede expresar como:
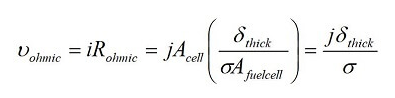
Donde Acell es el área activa de la pila de combustible, es el espesor de la capa de electrolito y σ es la conductividad. Como se ve en la ecuación 7, el potencial óhmico se puede reducir usando una capa de electrolito más delgada y un electrolito de mayor conductividad iónica.
es el espesor de la capa de electrolito y σ es la conductividad. Como se ve en la ecuación 7, el potencial óhmico se puede reducir usando una capa de electrolito más delgada y un electrolito de mayor conductividad iónica.
Conductividad electrónica de los metales.
La conductividad electrónica de los metales utilizados en una pila de combustible es una consideración importante porque afecta la transferencia de carga de electrones para piezas hechas de metales como placas bipolares y colectores de corriente. La movilidad de los electrones libres en un conductor metálico está limitada por impurezas, imperfecciones de la red y dispersión de fotones. La concentración de portadores en un metal se puede calcular a partir de la densidad de electrones libres, y el número de electrones libres depende de las propiedades del tipo de metal.
Conductividad iónica en electrolitos acuosos
Hay varios tipos de pilas de combustible que utilizan electrolitos acuosos. Los MCFC utilizan (K/Li)2CO3 fundido, los PAFC utilizan H3PO4 acuoso o concentrado y los AFC utilizan un electrolito de KOH acuoso. El electrolito acuoso queda atrapado en un material de matriz como soporte. El material de la matriz no sólo sujeta mecánicamente el electrolito, sino que también evita el cruce de gases reactivos y crea una distancia corta entre los electrodos (normalmente 0,1 – 1 mm).
Conductividad iónica de electrolitos poliméricos
En los electrolitos poliméricos, la conductividad aumenta exponencialmente al aumentar la temperatura. Para que un polímero sea un buen conductor, debe tener un número fijo de sitios de carga y espacios abiertos. Los sitios cargados tienen la carga opuesta a la de los iones en movimiento y proporcionan un lugar de descanso temporal para el ion. Aumentar el número de sitios cargados aumenta la conductividad iónica, pero un número excesivo de cadenas laterales cargadas puede degradar la estabilidad del polímero. Los polímeros suelen tener una cierta cantidad de volumen libre, pero aumentar el volumen libre permite más espacio para que los iones se muevan a través del polímero. Los iones también se transportan a través de la membrana polimérica uniéndose a las moléculas de agua que se mueven a través de la membrana. Un polímero a base de politetrafluoroetileno (PTFE) persulfonado, conocido como Nafion, tiene una alta conductividad y es actualmente la membrana más popular utilizada para las pilas de combustible PEM. Nafion tiene una estructura similar al teflón pero incluye grupos de ácido sulfónico (SO3–H+) que proporcionan sitios para el transporte de protones. La Figura 3 muestra la molécula química de Nafion.
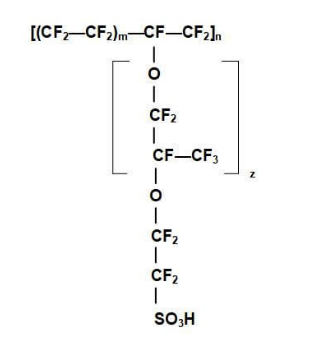
Figura 3: Estructura química de Nafion
Nafion tiene que estar completamente hidratado con agua para tener buena conductividad. La hidratación se puede lograr humidificando los gases o mediante un diseño de celda de combustible que permita que el agua del producto hidrate la membrana. En presencia de agua, los protones forman complejos de hidronio (H3O+), que transportan los protones en la fase acuosa. Cuando el Nafion está completamente hidratado, la conductividad es similar a la de los electrolitos líquidos.
Conducción iónica en electrolitos cerámicos
La mayoría de los tipos de pilas de combustible de temperatura media a alta utilizan un electrolito cerámico para el transporte de iones. El material electrolítico de alta temperatura más popular es la circona estabilizada con itria (YSZ), que se utiliza en pilas de combustible de óxido sólido (SOFC). Agregar itria al circonio introduce vacantes de oxígeno, lo que permite a YSZ conducir iones de manera eficiente.
Dado que se requieren vacantes para que los iones se muevan dentro de la cerámica, se los considera portadores de carga. El aumento del contenido de itria produce un aumento de las vacantes de oxígeno, pero el dopaje tiene un límite superior. El dopaje excesivo hará que los defectos interactúen entre sí y disminuyan la conductividad. La cantidad máxima de dopaje es de aproximadamente un 8 por ciento de concentración molar de itria para YSZ.
Resumen
El transporte de carga se realiza predominantemente por conducción. Las pérdidas por resistencia óhmica incluyen la resistencia de los electrodos, electrolitos e interconexiones; sin embargo, la resistencia general está dominada por la resistencia del electrolito. Dado que la resistencia es proporcional a la conductividad, el desarrollo de materiales de electrodos y electrolitos de alta conductividad es fundamental para un buen rendimiento de la pila de combustible. Los electrolitos no sólo deben ser conductores, sino también estables en un entorno químico y capaces de soportar las temperaturas requeridas de la pila de combustible.

